国家药监局:豁免1400种医械临床实验,影响大批械企
2019-08-06 9796
8月1日,国家药监局器审中心发布《免于进行临床试验医疗器械目录(2019年修订稿征求意见稿)》(下称“2019版《豁免目录(意见稿)》”),共996种医疗器械和420种体外诊断试剂免于进行临床试验。
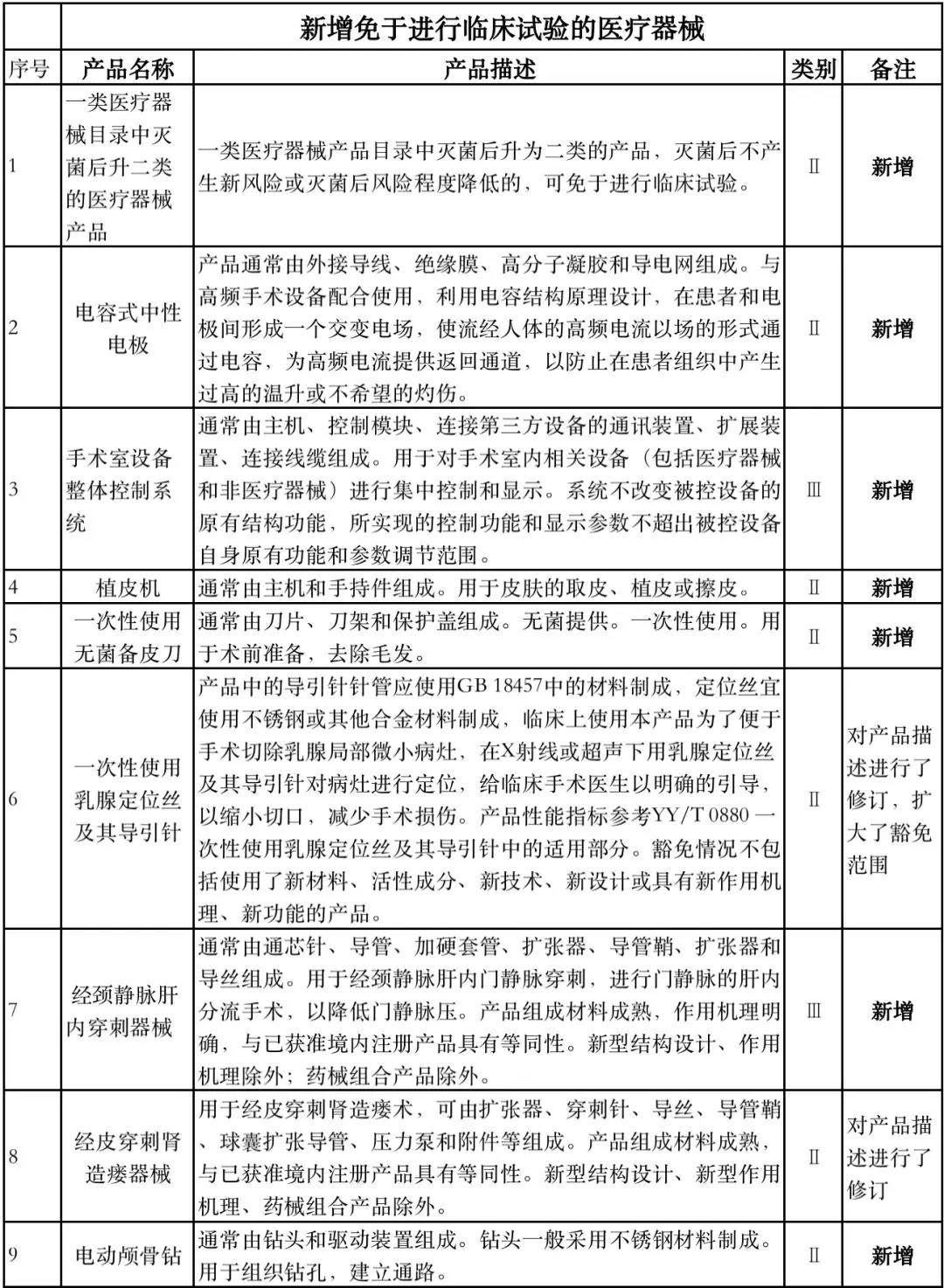
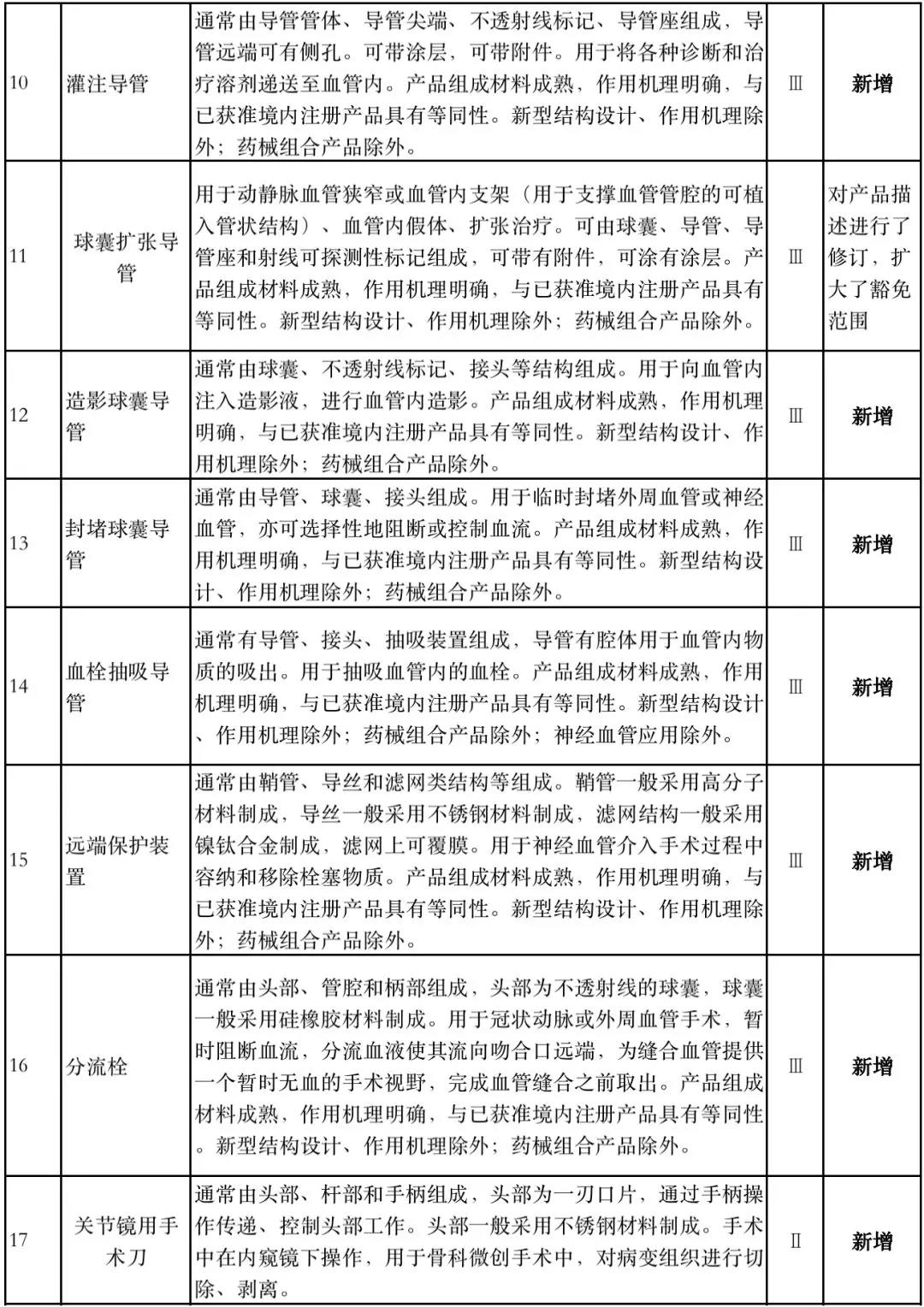
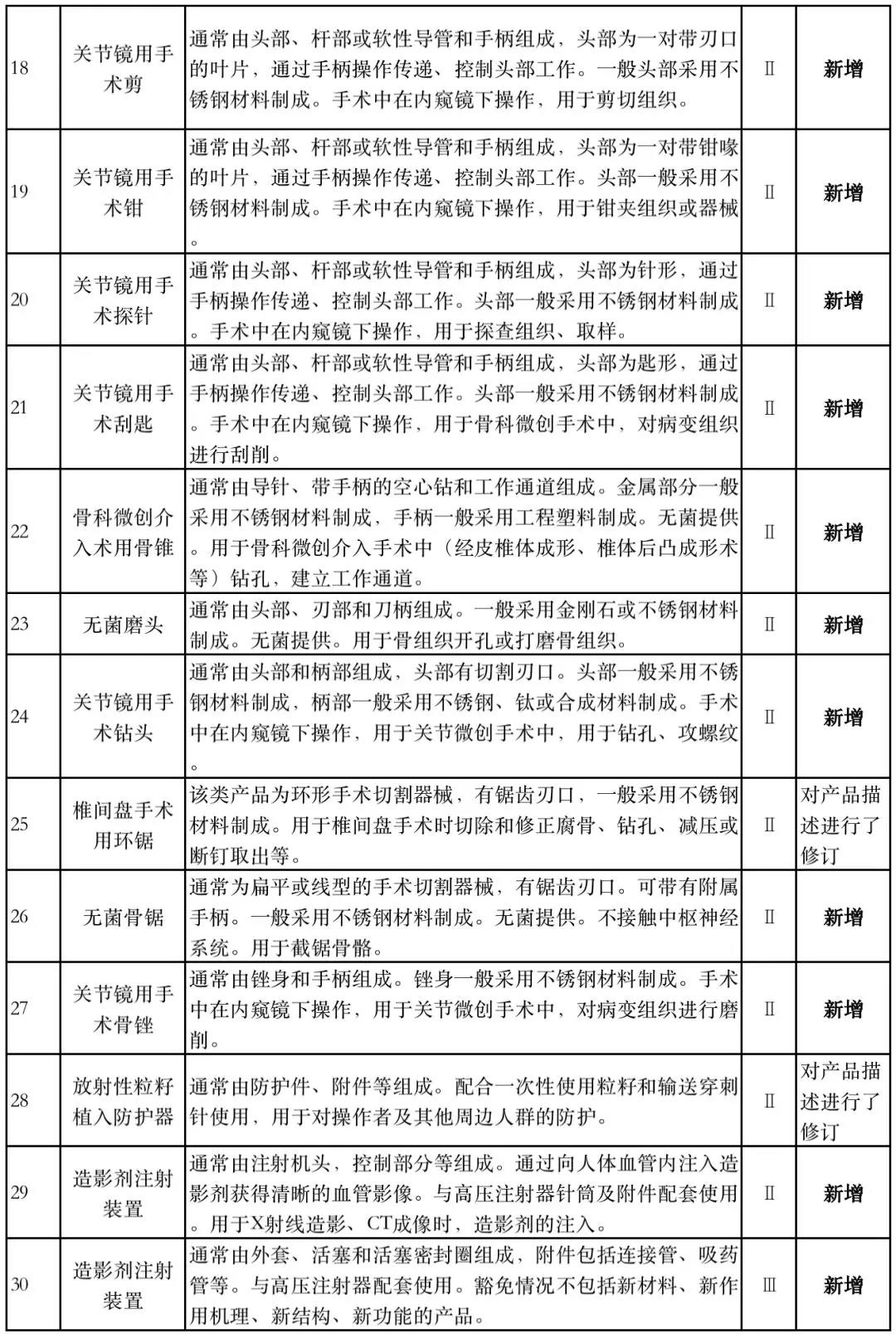
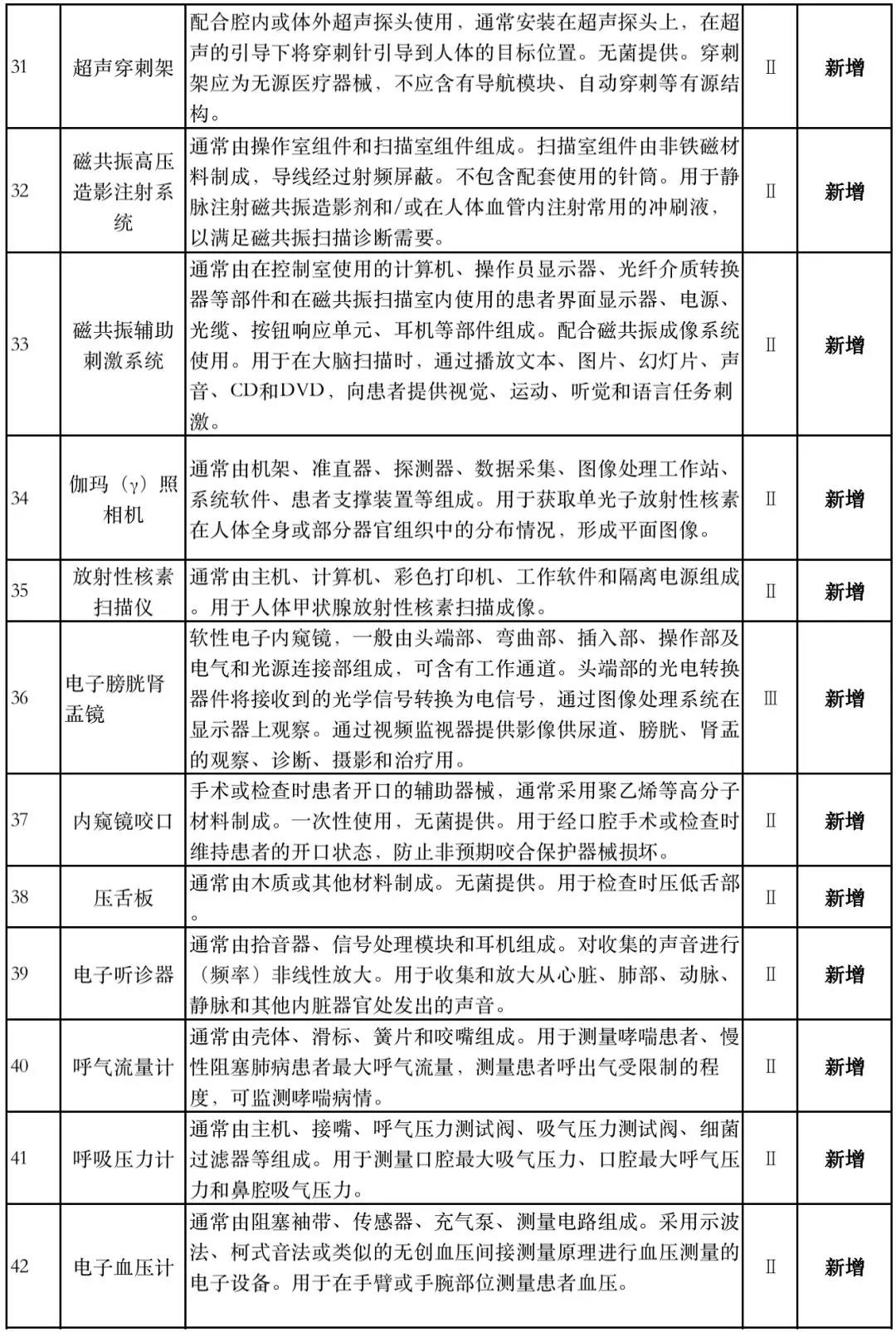
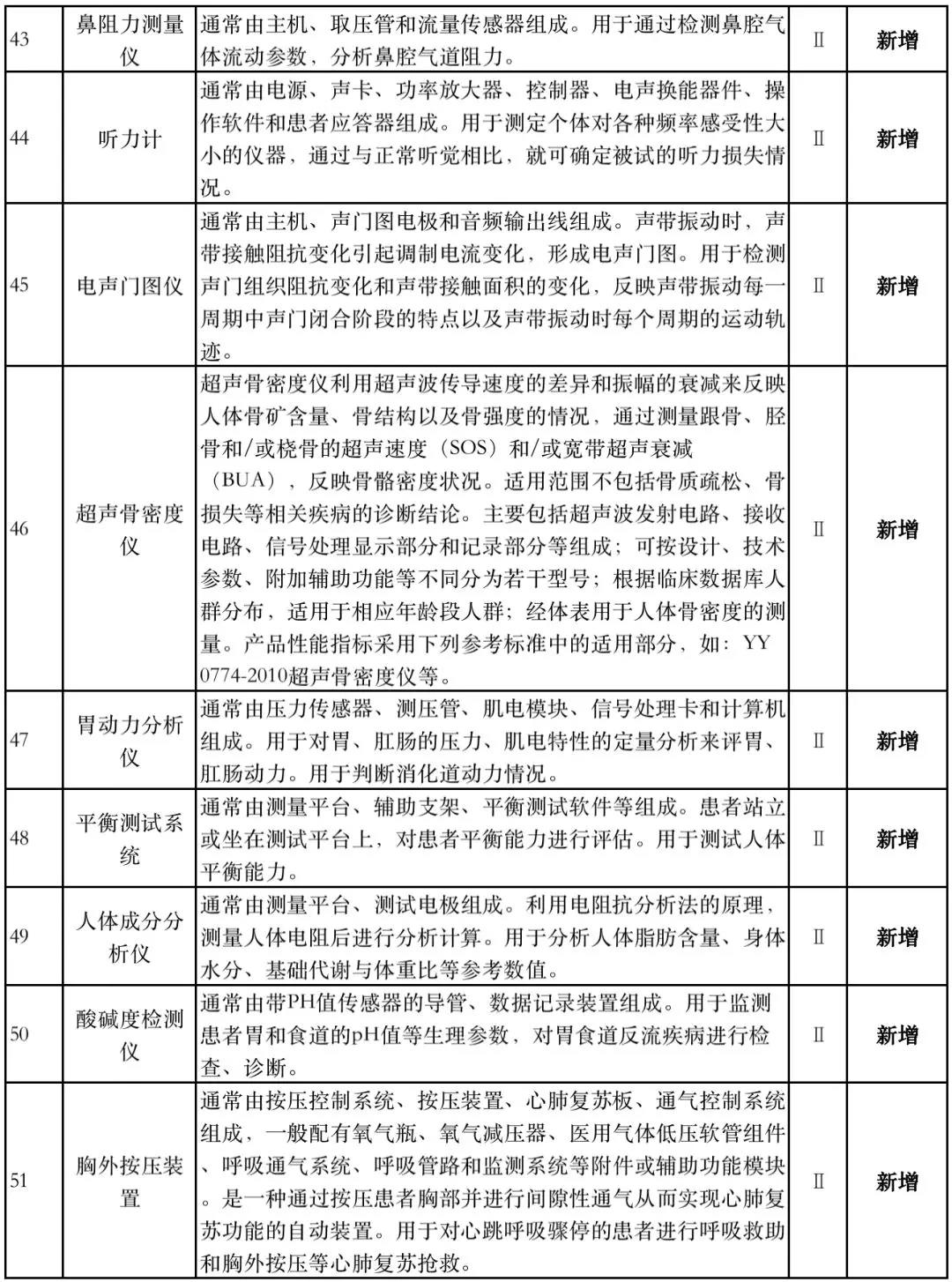
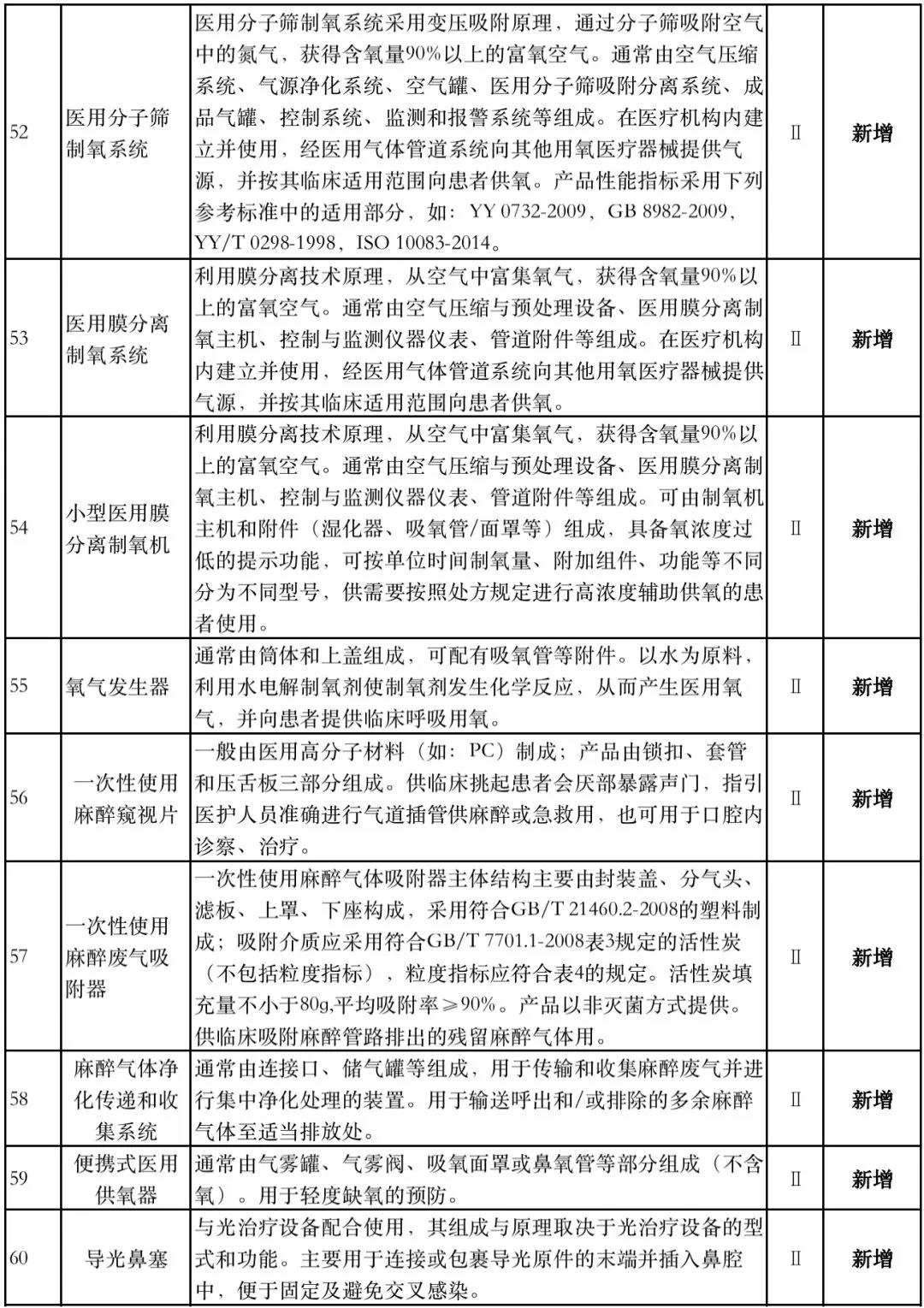
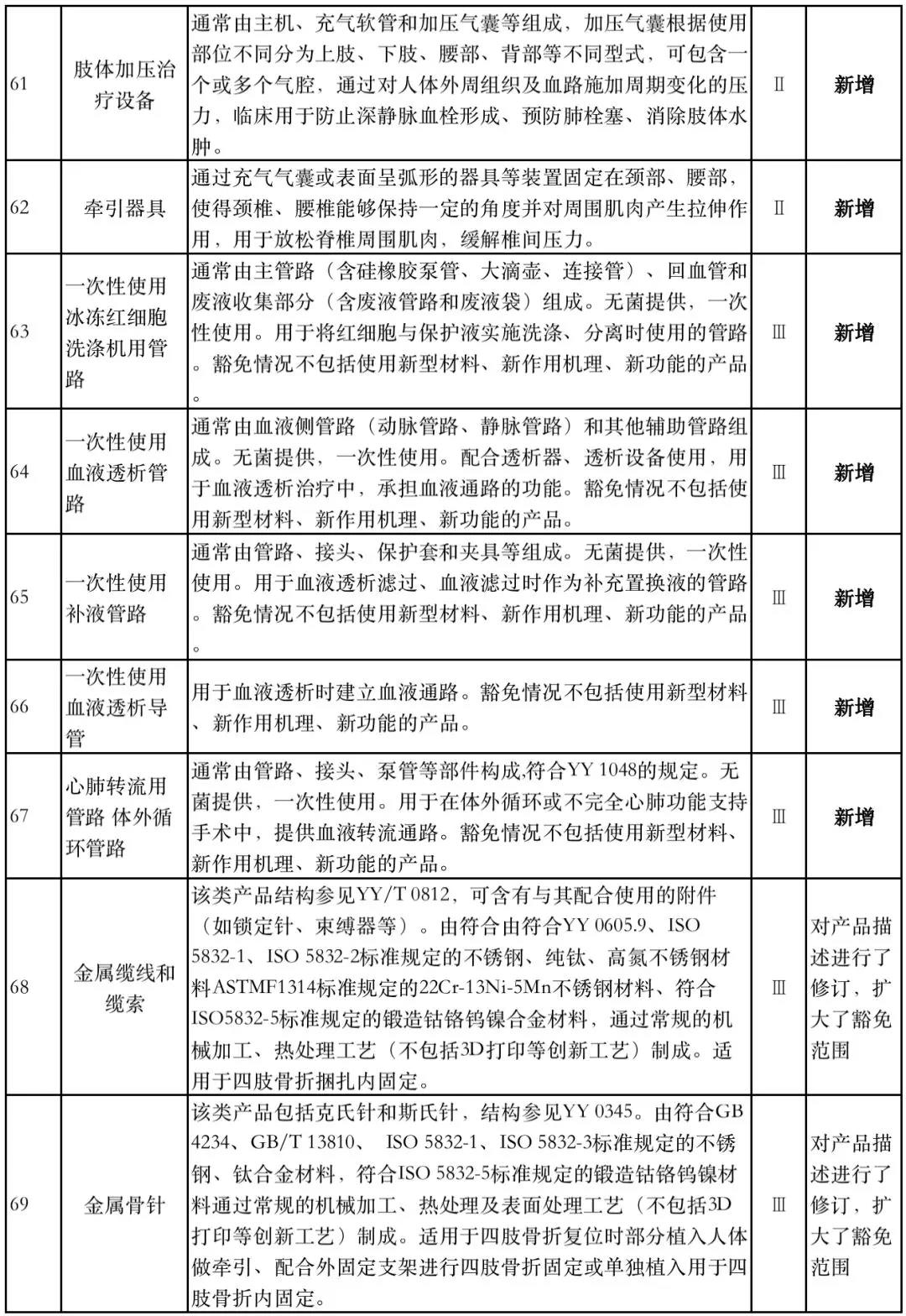
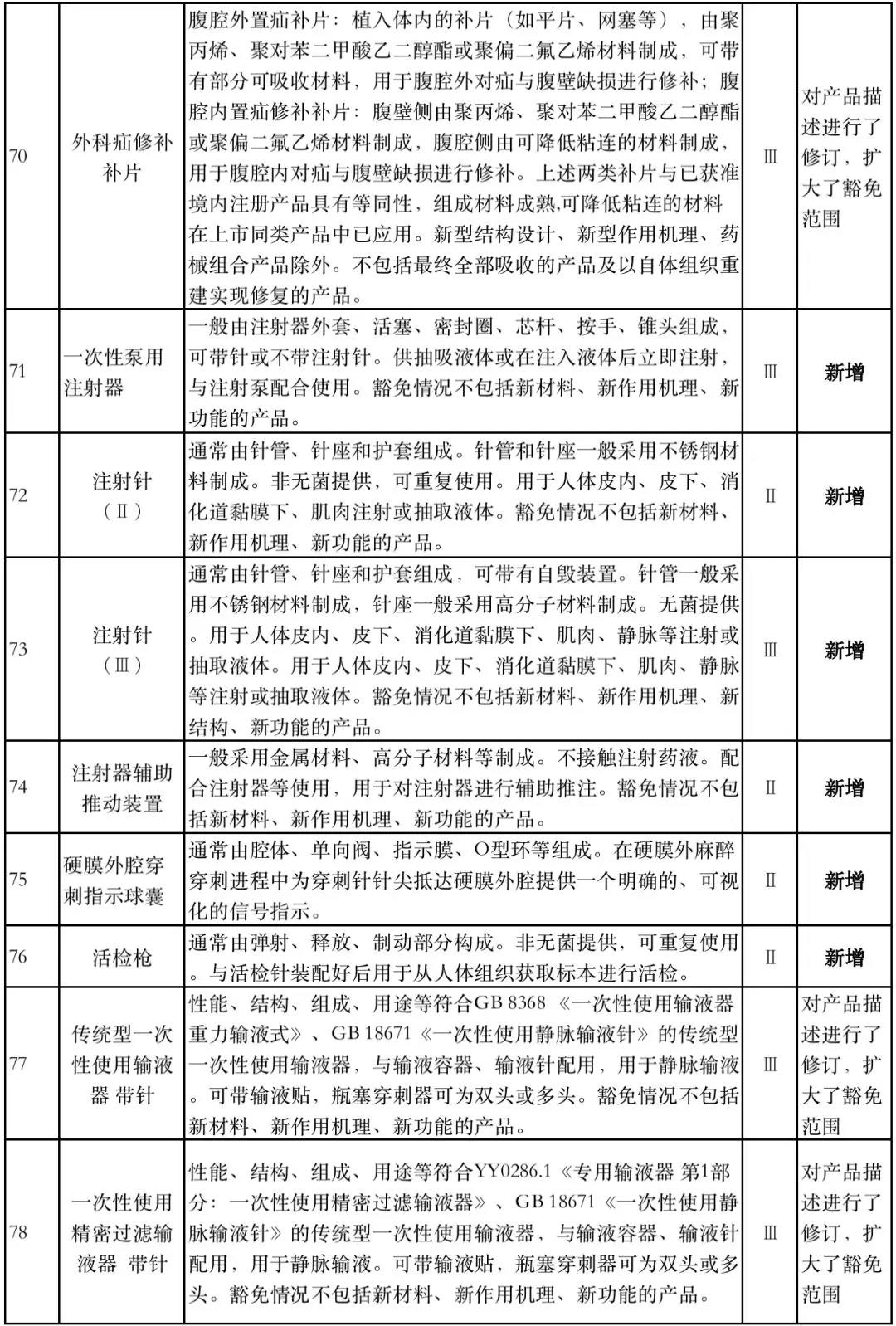
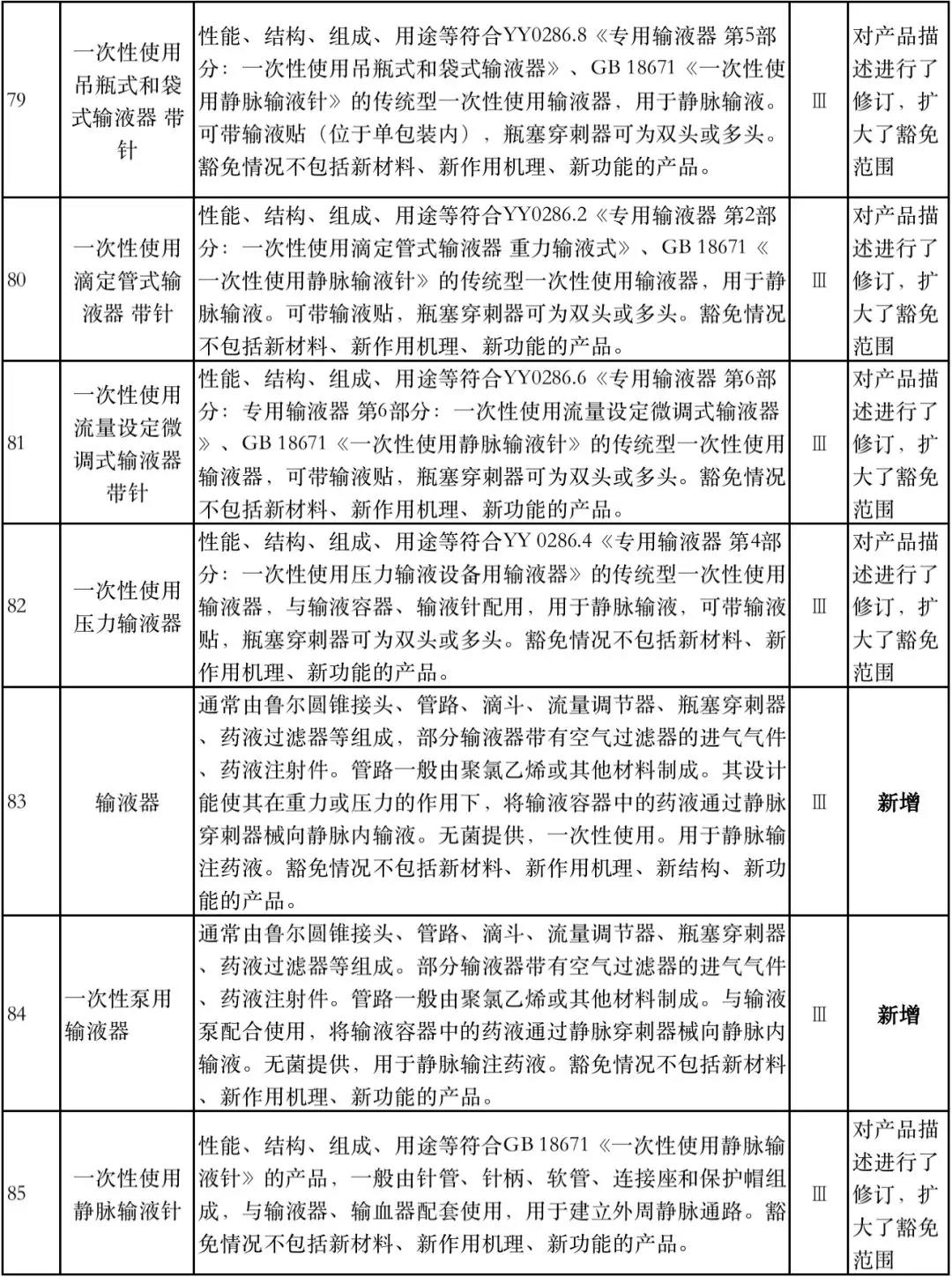
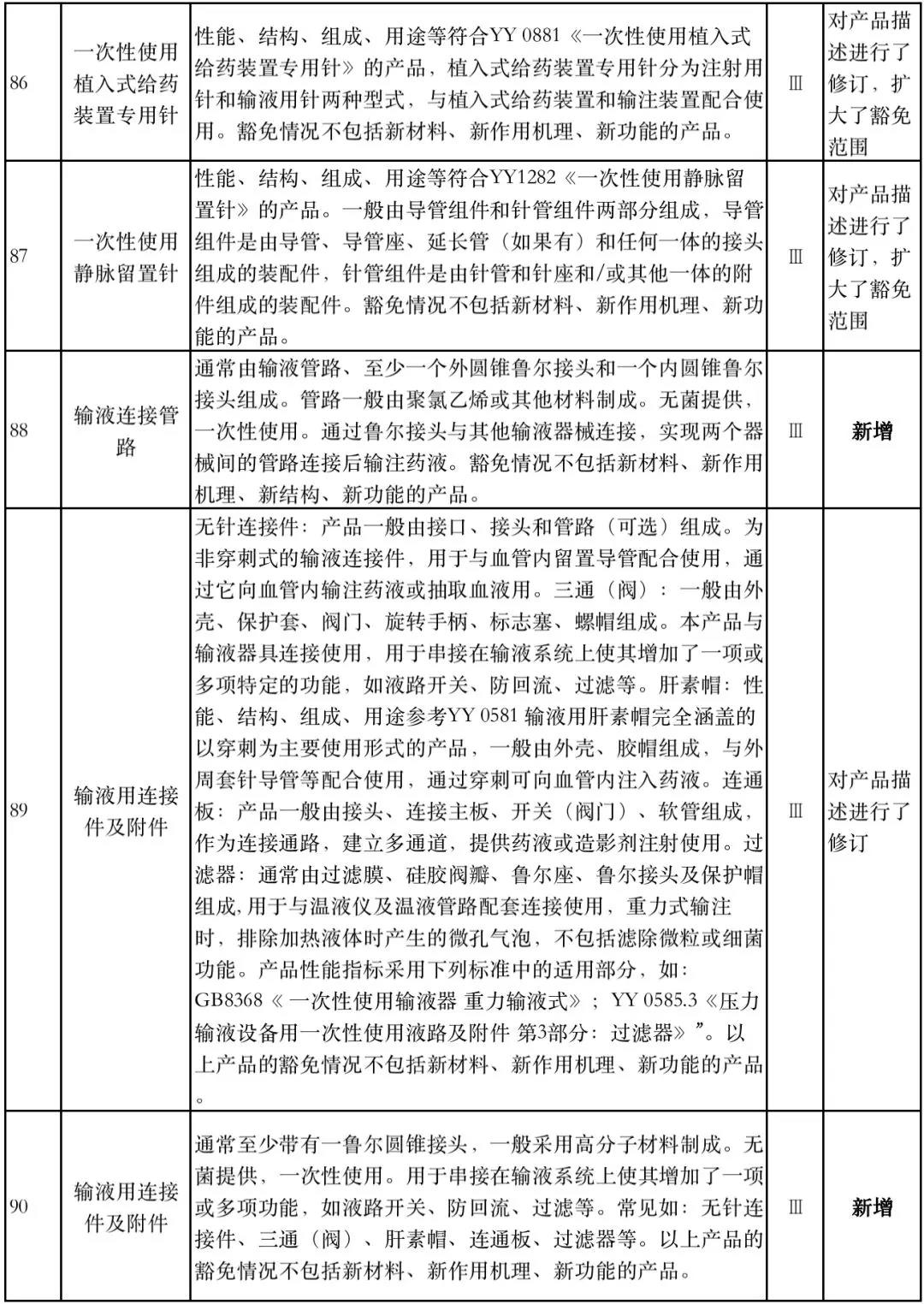
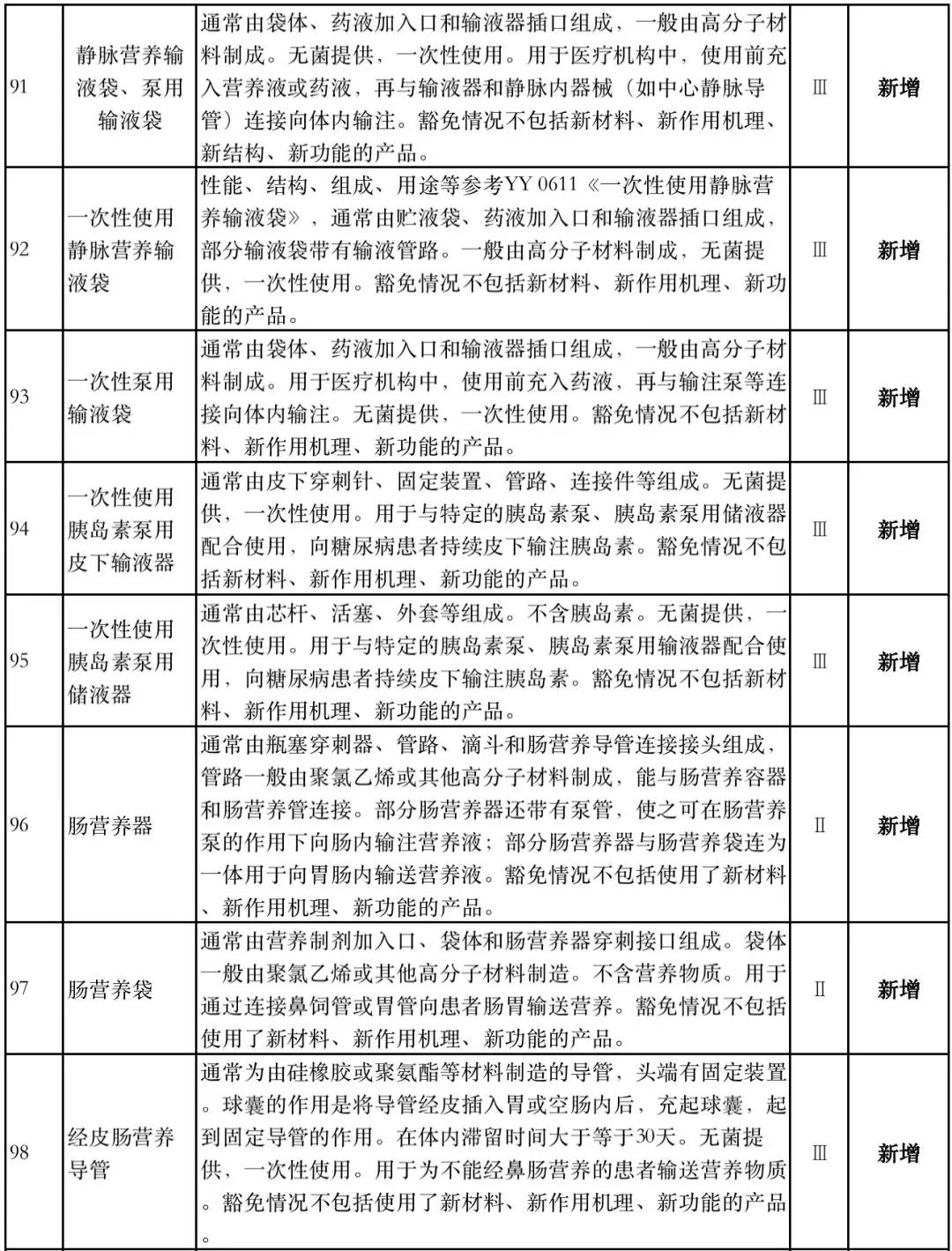
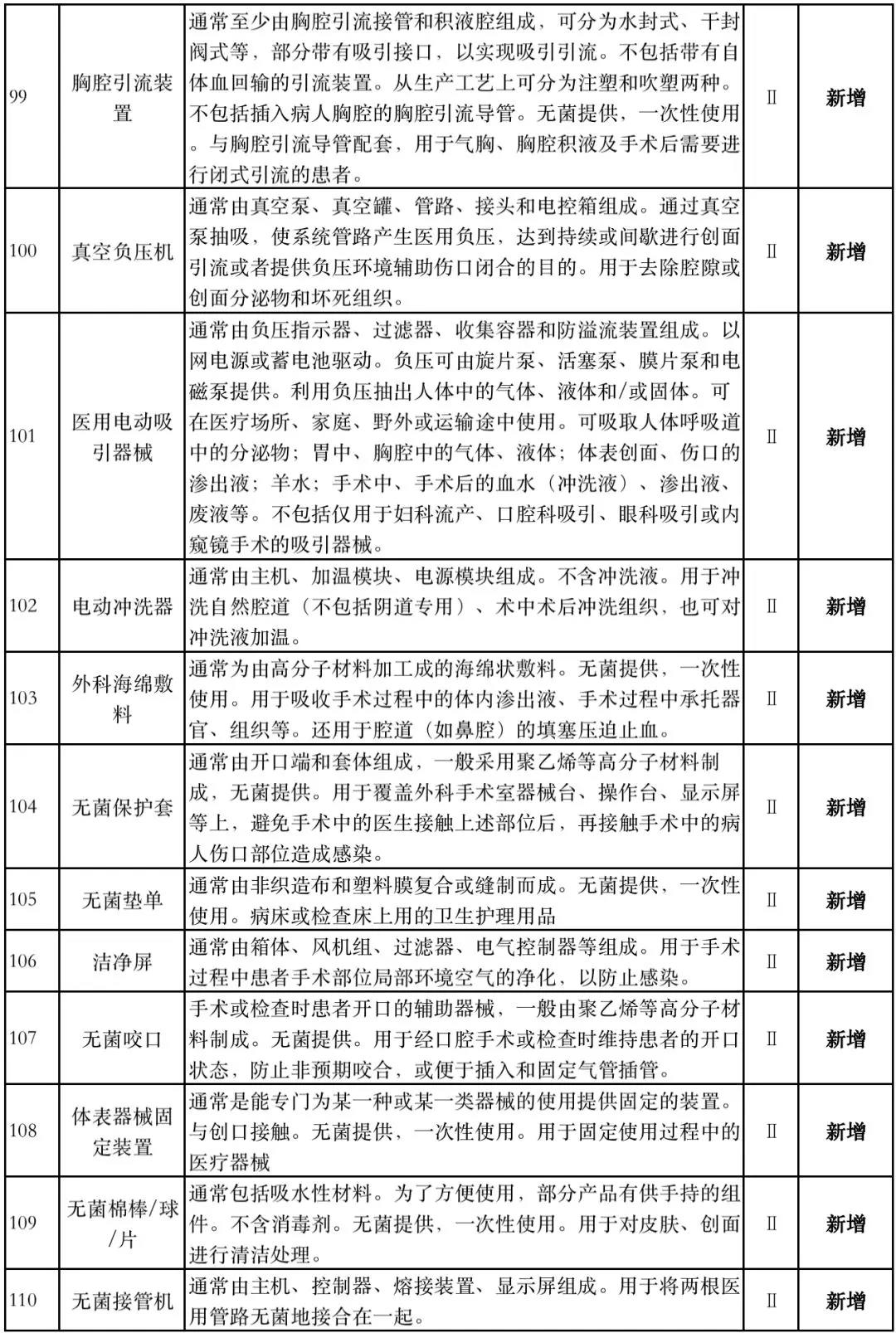
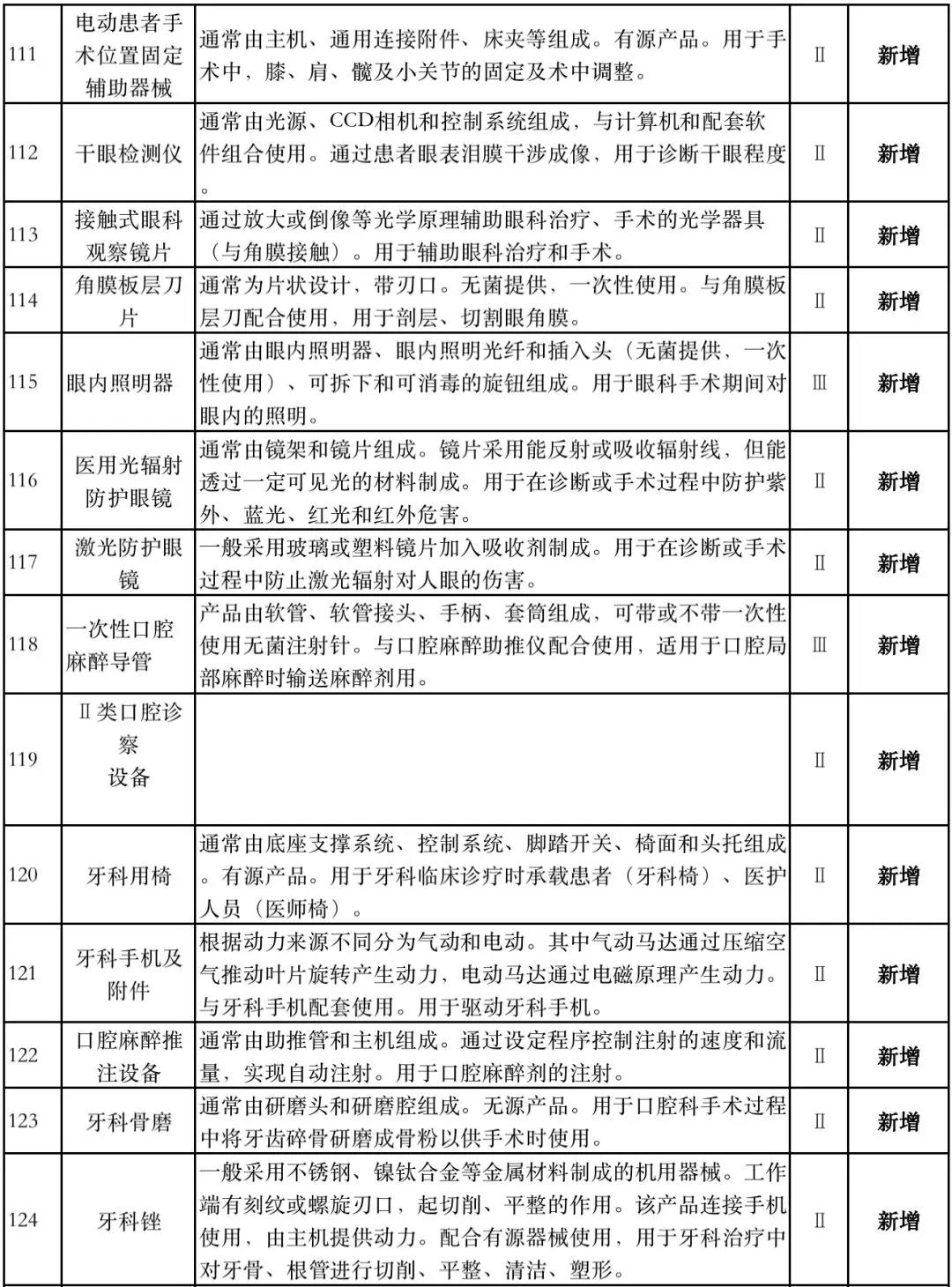
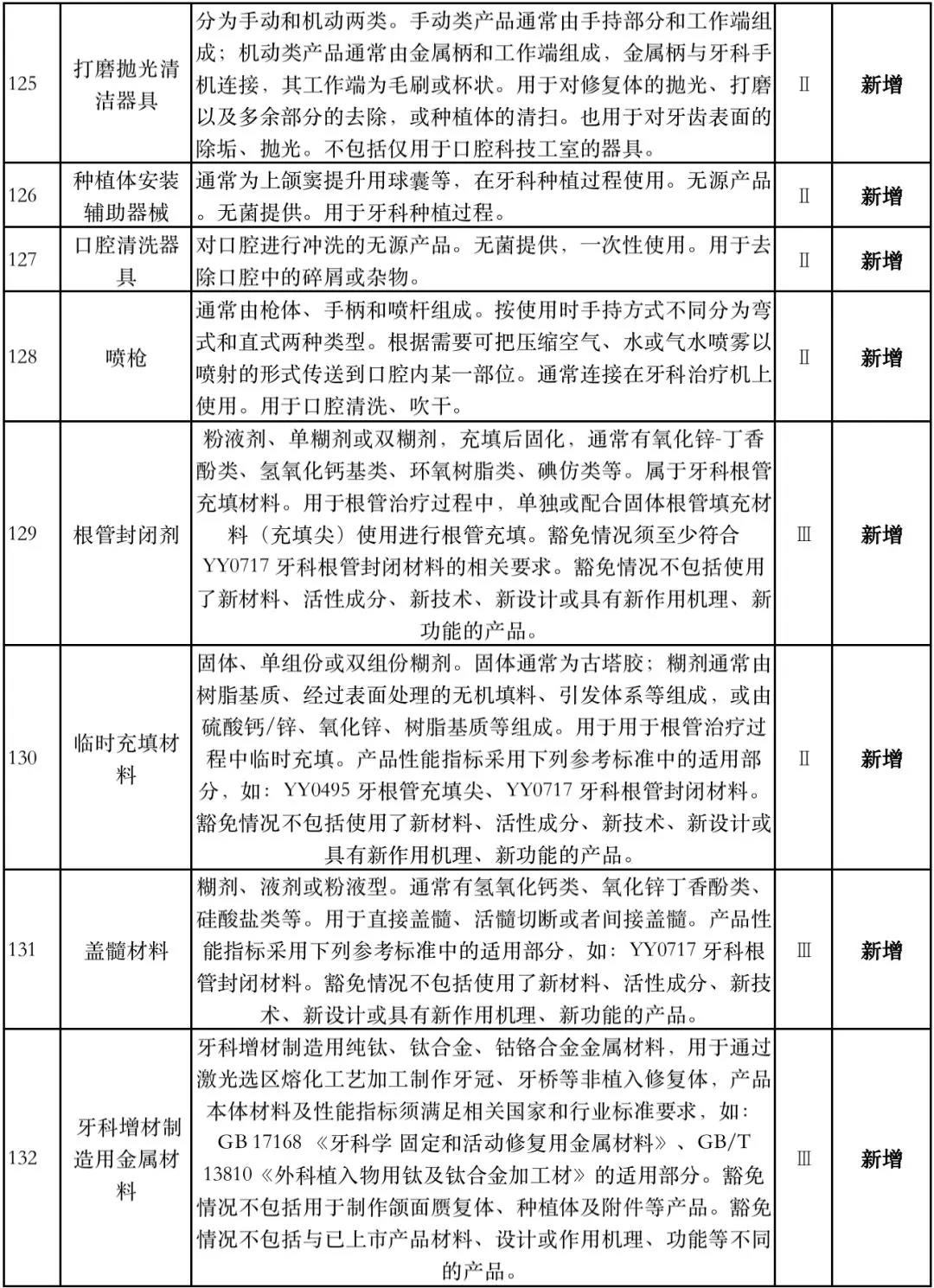
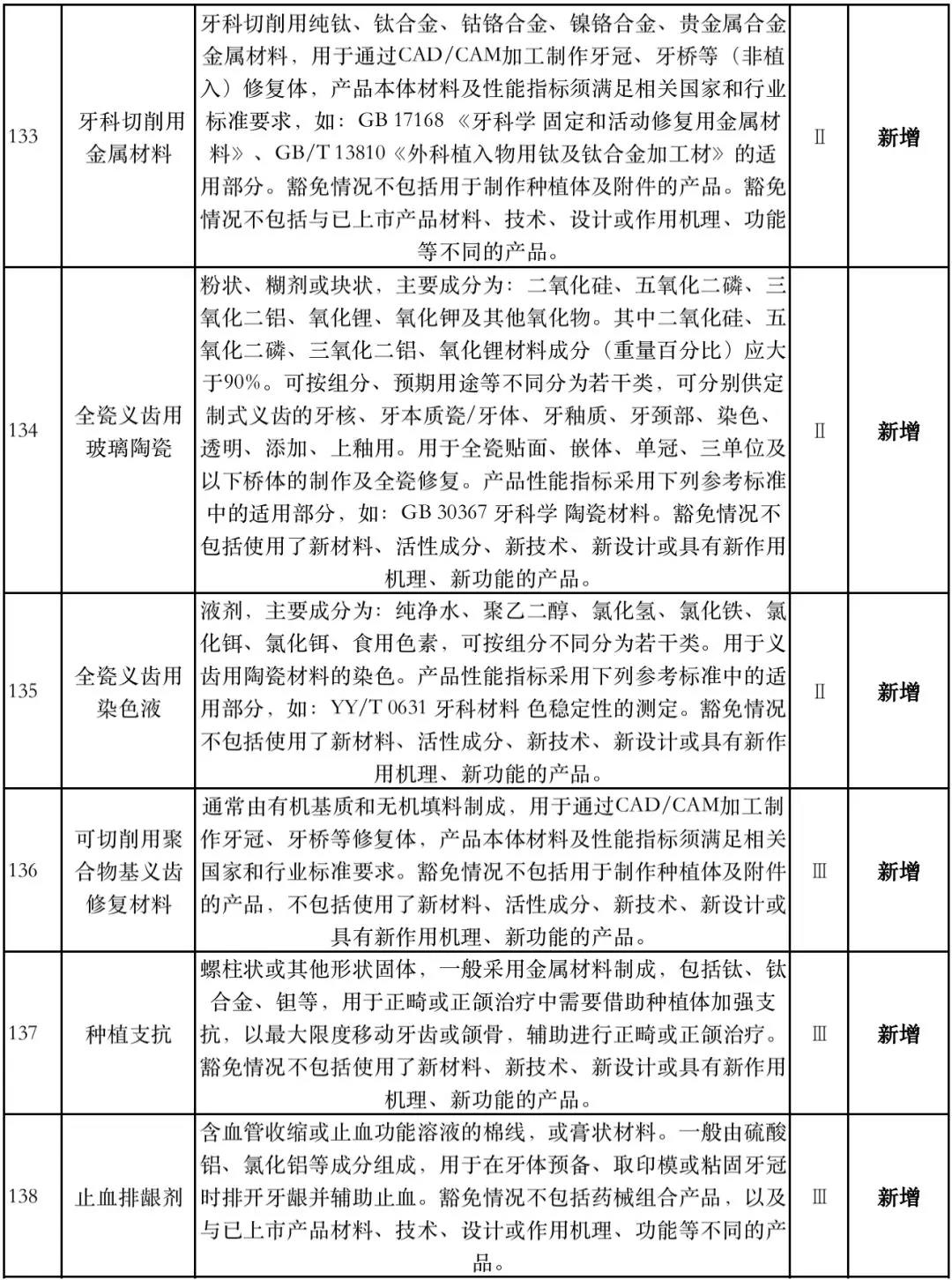
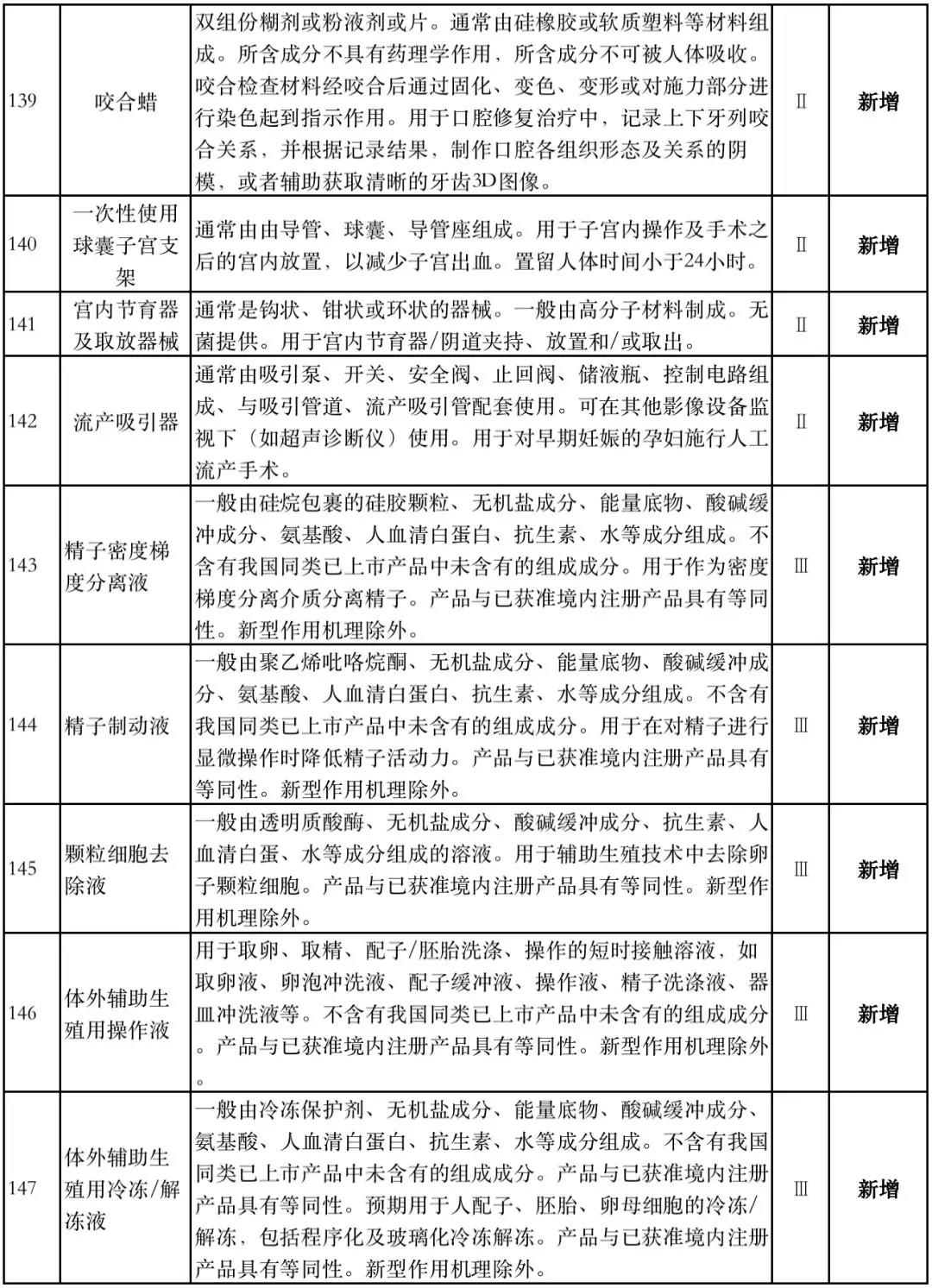
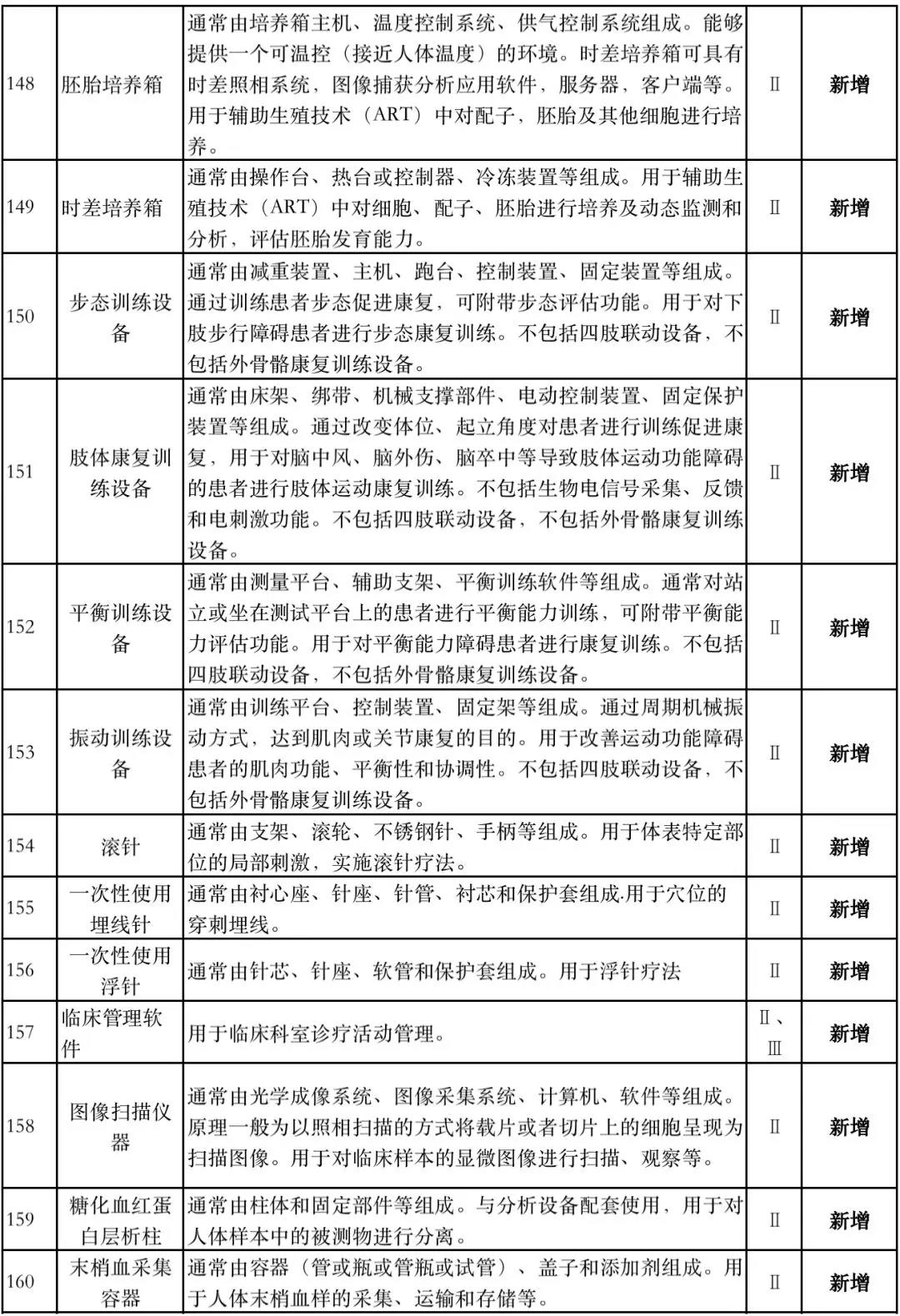
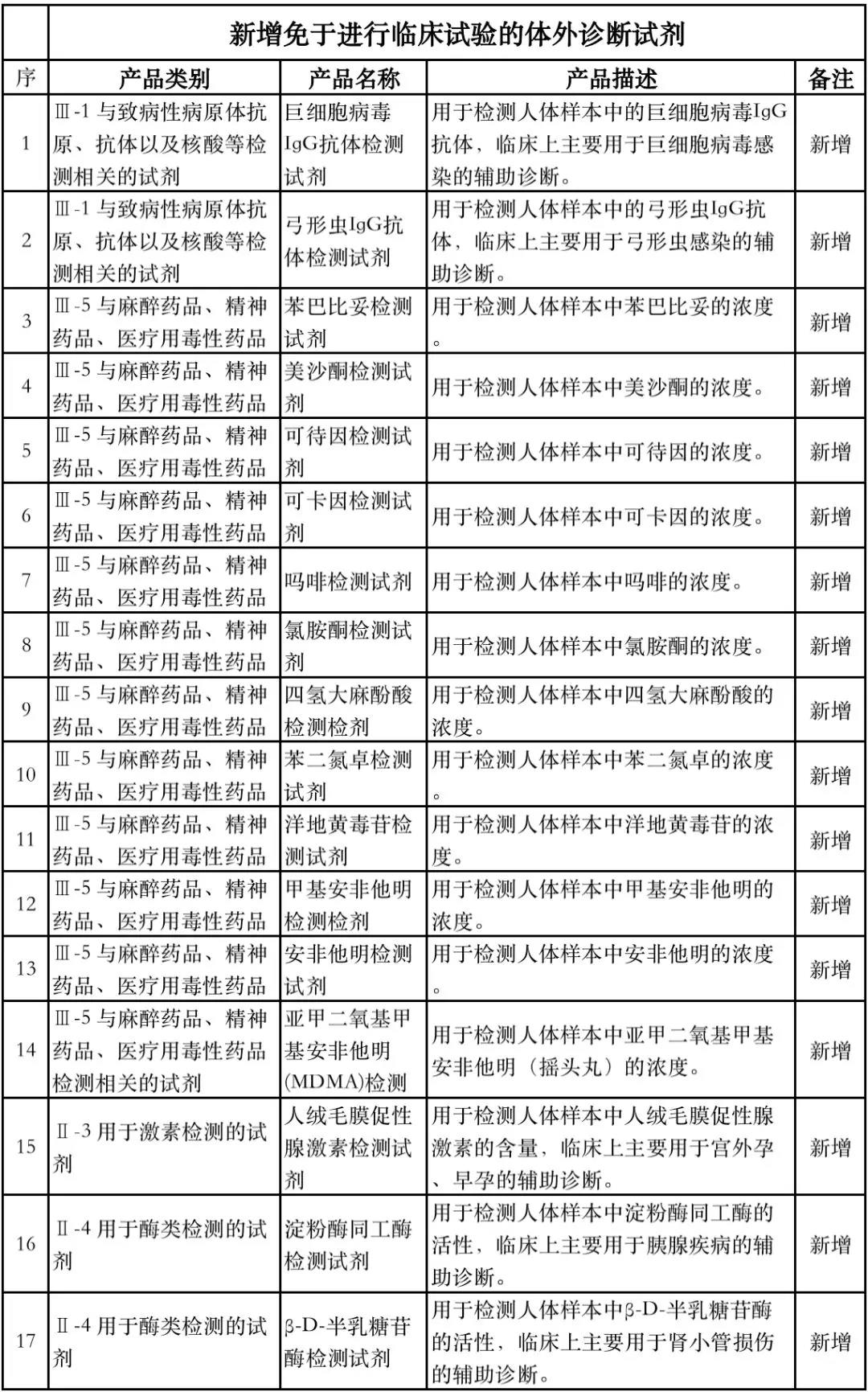
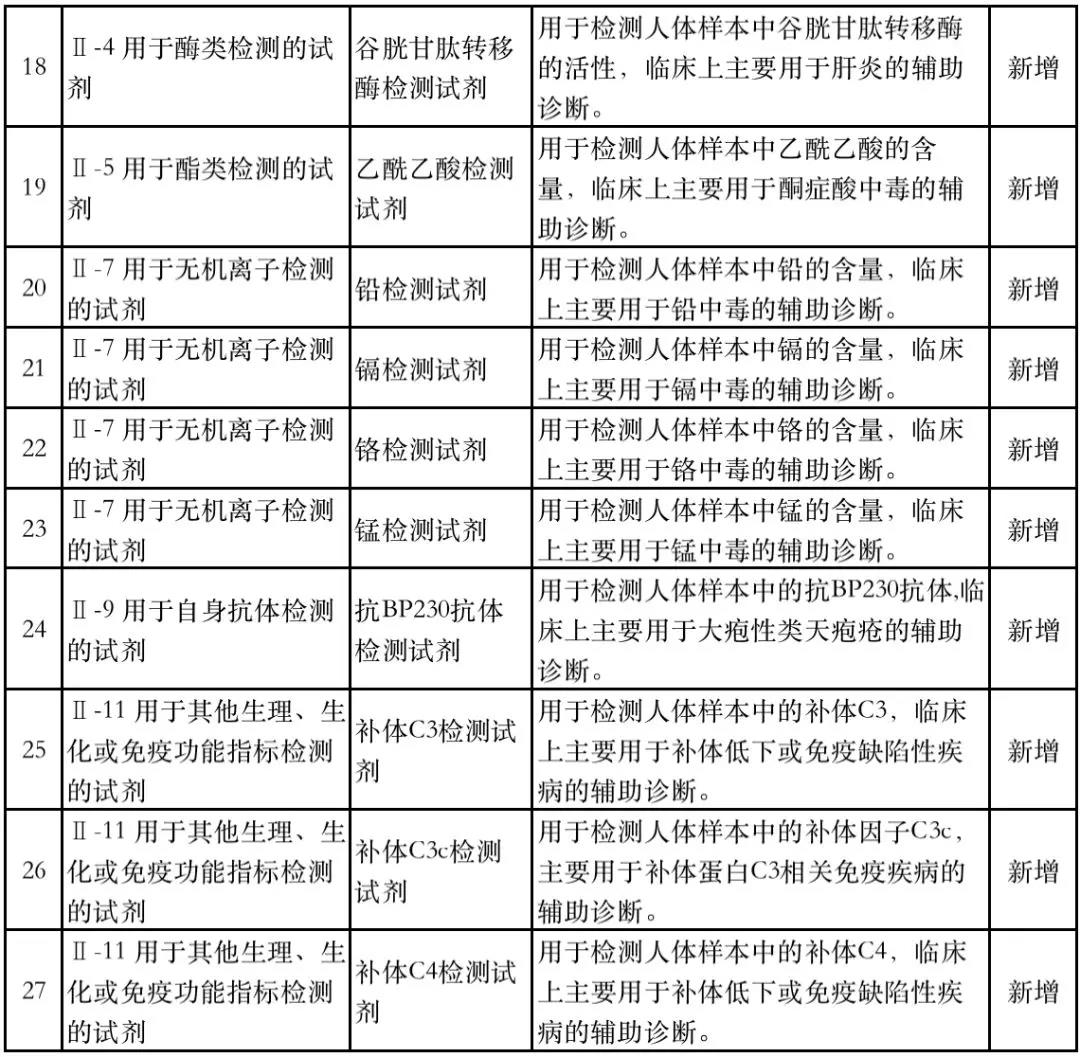
据赛柏蓝器械统计,和2018版相比,2019版《豁免目录(意见稿)》新增142种医疗器械和27种体外诊断试剂,还对19种医疗器械扩大了豁免范围或对描述进行了修订,新增的142种医疗器械包括102种II类和40种III类医疗器械。
实际上,这是第五批免于进行临床试验的医疗器械,2018版《豁免目录》包含前四批,共1248种,其中医疗器械855种,体外诊断试剂393种,较前三批增加了84种医疗器械和277项体外诊断试剂。
不断扩充目录,增加免于进行临床试验的医疗器械,可以有效降低成熟度高、风险较低产品临床试验方面的要求,同时减轻企业负担,使企业能将更多的精力投入到产品研发和质量提升上。
同时也有利于优化临床试验和审评审批资源,把宝贵的资源投入到临床急需和创新医疗器械产品上去,促进安全有效、风险可控的产品尽快上市。
附:新增免于进行临床试验的医疗器械和体外诊